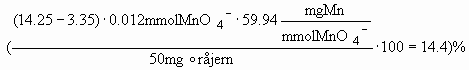Opgave 10
2Fe2O3 + 3C ®
4Fe + 3CO2 . (1)
Der er kul i støbejern. Kul gør jernet hårdere.

Der identificeres Mn i malmen.
Prøven oxideres kraftigt, så jern ender som Fe3+ og mangan ender som MnO4-. Den dannede permanganat behandles med en kendt mængde jern(II), som er i overskud i forhold til permanganat: De reagerer i sur væske således:
5Fe2+ + MnO4- + 8H+ => 5Fe3+ + Mn2+ + 4H2O . (2)
Overskudet af jern(II) titreres tilbage med en opløsning af kaliumpermanganat med kendt koncentration (fx bestemt med natriumoxalat).
2MnO4- + 5C2O42- + 16H+ => 2Mn2+ + 10CO2 + 8H2O . (3)
Her blev koncentrationen bestemt til 0.0120M
Titreringen med kaliumpermanganat er slut når en dråbe kaliumpermanganat opløsning farver væsken rød.
Jern(II) mængden har altså reageret med den fra prøven dannede permanganat + den mængde kaliumpermanganat, der blev titreret med:
Vi kan se af reaktionsskema (2) at jernmængden er 5 gange så stor som den samlede mængde permanganat. Det betyder at :
Vjern(II)xCjern(II) = 5x(CkaliumpermanganatxVkaliumpermanganat + npermanganat i prøve )
Først bestemmes Cjern(II) ved at titrere på blindprøven, hvor mængden af dannet permanganat er 0:
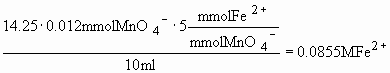 .
.
Herefter kan man bestemme mængden af dannet permanganat i prøven og derefter %indholdet af mangan i prøven

Man kan også regne det samme ud uden at bestemme jern(II) koncentrationen separat:
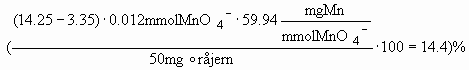


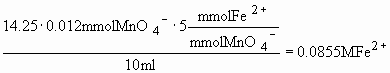 .
.