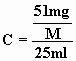 ,
,D2 side 52
Bestem antallet af krystalvand i kobbersulfat, når en opløsning af 51 mg heraf i 25 ml 2 M ammoniak giver A(600nm) = 0.80, idet e (600nm) = 49 l·mol-1·cm-1 for [Cu(NH3)4 ] 2+ og l =2 cm
A(600) = e (600nm)·C· l .
Indsættes værdierne fås 0.80 = 49 l·mol-1·cm-1 · C · 2 cm
Heraf findes at
C = 0.80/(2·49) mol/l,
idet C er den molære koncentration af [Cu(NH3)4 ] 2+ og dermed af Cu2+ i opløsningen af 51 mg kobbersulfat CuSO4·XH2O i 25 ml 2 M ammoniak .
Koncentrationen i opløsningen kan derfor alternativt findes ved
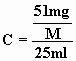 ,
,
Sættes de to udtryk for koncentration lig hinanden fås
![]()
Molarmassen af CuSO4·XH2O er jo (63.5 + 96 + X·18 som er fundet til 250 ) g/mol
Heraf findes X til 5.0.
Det lyseblå kobbersulfats formel kan da skrives CuSO4·5H2O