Molekylformel: P4O10
Strukturformel: 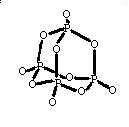
Ækvivalentvægt1
med hensyn til en komponent.JJ/11.00
Sumformlen eller den empiriske formel for et rent stof angiver udelukkende det relative forhold mellem de atomer, som stoffet er opbygget af. Molekylformlen afspejler hvilken mindste del af stoffet, der stadig har dets kemiske egenskaber. Strukturformlen for et stof indeholder information om den rumlige opbygning. At finde sumformlen for et rent stof ud fra analytiske data er en mellemstation til (en forudsætning for) at kunne beskrive stoffets opbygning.
Molekylformel: P4O10
Strukturformel: 
2P + 5O2
® P2O5. Det betyder, at reaktionens støkiometri er givet ved: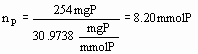
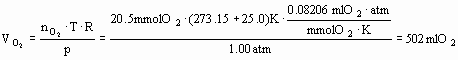
Bemærk: i størrelsesligningen indsættes tal og enheder, som hver især ganges og forkortes efter regneforskriften. Specielt er den enhed der kommer ud af det hele en kontrol på at størrelsesligningen (altså regneforskriften) er rimelig.
De rå analytiske data er resultatet af eksperimenter, som kan være af flere tilsnit.
Fælles for de fleste er imidlertid, at der benyttes en metode, som kan afsløre en stofmængde nA af en komponent A i en masse-portion mU af det analyserede rene stof U. Det relative forhold mellem disse to størrelser er nyttig og kaldes ækvivalentvægten UÆA af det rene stof U med hensyn til komponenten A. UÆA = mU/nA. Enheden er gU/molA.
EX1(fortsat)
I et rent stof U hvori der kun er fundet P og O er der fundet 3.33 mmol P i en portion på 236 mg U.U
ÆP = 236·mgU/3.33,mmolP = (70.87xx=70.9)·gU/molP.Bemærk 1: 3 betydende cifre i massen og stofmængden og derfor også i resultatet.
Bemærk 2: En størrelse kan betragtes som produktet af et tal og en enhed.
70.9 g U indeholder altså netop 1 mol P med MP = 30.9738·gP/molP. Resten er oxygen . U har sumformlen POx og vejer pr. mol det samme som UÆP : UÆP·(nP/nPox) = MP·(nP/nPox) + MO·(nO/nPox) eller
70.9· (gPOx/molP)·1·(molP/molPOx) = 30.9738·(gP/molP)·1·(molP/molPOx) + 15.999·(gO/molO)·x·(molO/molPOx).
Heraf findes x til 2.50 (rent tal). Sumformler angives sædvanligvis med hele tal, så den empiriske formel for U er her fundet til P2O5.
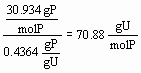
Videre gælder at 70.88 = 30.934 +x·15.9994, hvoraf x = 2.500. Da sumformler indeholder hele tal skrives sumformlen ikke PO2.5 , men som P2O5
De fleste beregninger må forholde sig til hvordan de analytiske data er opnået.
Masse-portionen mU af det analyserede rene stof U bestemmes ved vejning.
Stofmængde nA af komponenten A kan bestemmes ved hjælp af forskellige metoder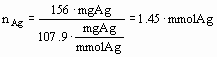
EX2: Ved elektrolyse på en opløsning af en portion på 246 mg af et stof U, hvori der er identificeret sølvioner og ikke andre metaller, er der afsat netop 156mg sølv på platinkatoden.
![]()
som fandtes i 246 mg U. Ækvivalentvægten UÆAg af det rene stof U med hensyn til Ag er da
Resultat med tre betydende cifre.
(Tallene er konstruerede med stoffet sølvnitrat med M=169.873g/mol i tankerne)
EX2(fortsat) Ved at fælde med overskud af saltsyre på en portion på 246 mg af et stof U, hvori der er identificeret sølvioner og ikke andre metaller, er det ved vejning konstateret at der er dannet netop 208 mg sølvchlorid.
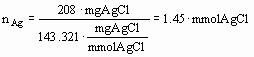
Da der er 1 mol Ag pr mol AgCl, er der 1.45 mmol Ag i portionen på 246 mg U og ækvivalentvægten findes som ovenfor (det var også sølvnitrat).
EX2(fortsat) En opløsning af en portion på 246 mg af et stof U, hvori der er identificeret sølvioner og ikke andre metaller, titreres til rødfarvning med netop 14.5 ml 0.100 M kaliumchlorid-opløsning med kaliumchromat som indikator. nAg = {(14.5·0.100)/1 = 1.45}mmol. (Stoffet U er det samme som før ).
EX2(fortsat) Ved at reducere en opløsning af en portion på 246 mg af et stof U, hvori der er identificeret nitrat med et overskud af zink og svovlsyre dannes der en ækvivalent mængde ammoniumioner; nammonium = nnitrat = nN. Efter at have tilsat et godt overskud af stærk natriumhydroxid koges blandingen og destillatet (med ammoniak) opsamles i 12.50 ml 0.100M svovlsyre. Der titreres herefter tilbage med 10.5 ml 0.100M NaOH med methylrødt som indikator ( rød til gul). Af reaktionsskemaer fremgår at der går 2mol ammoniak til 1 mol svovlsyre og at der går 2 mol natriumhydroxid til 1 mol svovlsyre. nN = (nsvovlsyre - ½·nnatriumhydroxid)/½ ={2·(12.50·0.100 - ½·10.5·0.100) = 1.45}mmol N. (U er stadig sølvnitrat) Bemærkning. Normalt opsamles ammoniak i saltsyre i standard Kjeldahl analyse. Her er anvendt svovlsyre kun for at også at illustrere beregningen, når reaktionerne ikke foregår i molforholdet 1 til 1.
Flere analyser på samme stof U er basis for at kunne bestemme sumformlen for U. Dels giver de fundne ækvivalentvægte med hensyn til forskellige komponenter direkte det støkiometriske forhold mellem komponenterne. I tilgift ligger der den oplysning i de beregnede ækvivalentvægte om de fundne komponenter er de eneste komponenter i det rene stof.
EX2(fortsat) I det stof U, hvor der var fundet sølvioner (og ikke andre metaller) og nitrationer, har vi de to ækvivalentvægte som er bestemt ud fra uafhængige analysemetoder:
U
ÆAg = 170gU/mol Ag og UÆN = 170gN/mol N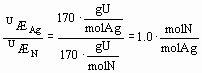
Forholdet mellem dem er vigtigt , selvom det i dette tilfælde er ret trivielt.
Udregningen viser at i stoffet U er forholdet mellem sølvioner og nitrationer 1 til 1, hvilket passer med forventningerne, idet anionen ladning på -1 og kationens ladning på +1 i et rent stof må forekomme i lige store mængder fordi U (som alle andre rene stoffer) ikke kan have nogen nettoladning.
Nu til spørgsmålet om stoffet er rent eller evt. indeholder en neutral komponent. At der i faste rene salte er budnet et antal vandmolekyler i krystalgitteret er hyppigt forekommende. Den største af de fundne ækvivalentvægte indeholder netop 1 mol af den sjældneste komponent (den med de laveste tal - 1 - i sumfomlen). Denne værdi må så også være sumformlens molarmasse. Og det kan bruges til at beregne om de fundne komponenter i det fundne forhold er alene i stoffet.
EX2(fortsat) Antager vi at vores stof U er rent, så kunne det jo indeholde krystalvand og have sumformlen
AgNO3
,xH2O. Dette stof har molarmassen MAg + MN + 3·MO + x·Mvandog værdien er fundet til 170 g/mol. Heraf kan x bestemmes til (170 - 108 - 14 - 48)/18 som er = 0.
U er med andre ord sølvnitrat, AgNO3, og indeholder altså ikke krystalvand.